Las moléculas y los compuestos se van formando siempre mediante diferentes tipos de uniones. Estas se pueden distinguir entre enlaces iónicos y covalentes. Gracias a estos enlaces, los átomos se unen entre sí y dan lugar a formaciones más complejas. Esa unión es posible mediante las uniones químicas de atracción.
El enlace iónico es aquel que se produce entre átomos que son diferentes. Un átomo es un metal y el otro es un no metal. Este tipo de unión química entre átomos se produce, entonces, al ceder un átomo uno de sus electrones a otro átomo. De esta manera uno sufre una pérdida de electrones y el otro una ganancia.
El enlace covalente, en cambio, se da entre átomos que son parecidos. En este caso los átomos no ceden electrones sino que los comparten. Es decir que, a diferencia del enlace iónico, en el covalente no hay pérdida o ganancia. De esta manera los átomos logran alcanzar el equilibrio uniéndose entre sí mediante una fuerza de atracción.
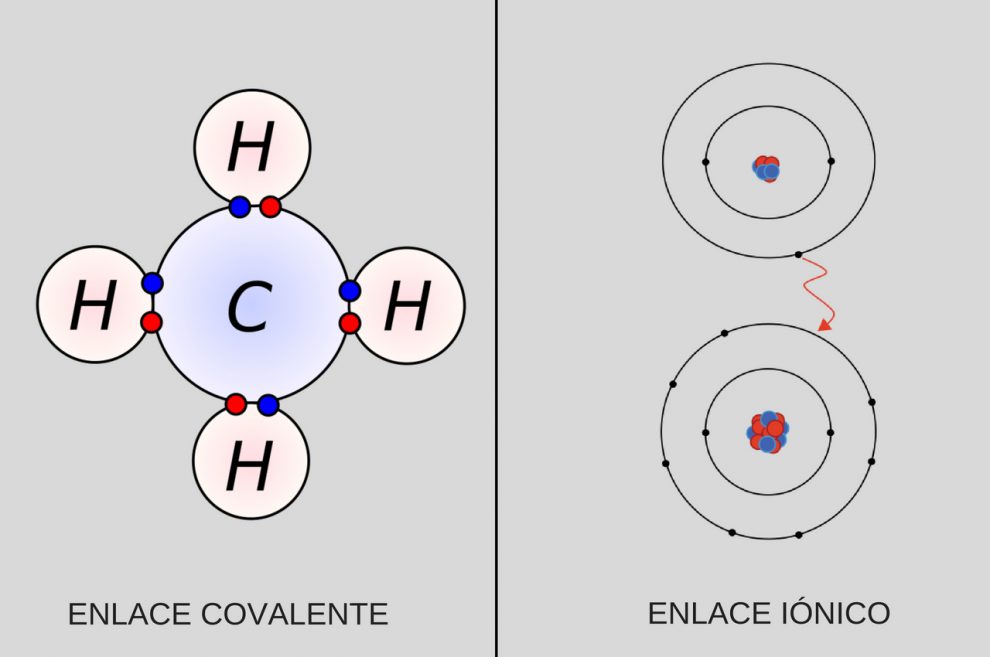
El enlace iónico puede ser metálico o no metálico. El metálico es aquel en el que hay una pérdida de un electrón del átomo que tiene carga positiva, en el no metálico el átomo que recibe el electrón posee carga negativa. De esta manera se demuestra la atracción entre cargas opuestas.
Los covalentes, por otro lado, se clasifican de modo diferente que los iónicos. Un enlace covalente puede ser triple, doble o simple. Esto depende de la cantidad de electrones que se comparten entre los átomos. Por ejemplo si un átomo tiene un electrón sobrante en su último nivel, otro átomo tomará ese electrón y entre ambos lo compartirán para estar en equilibrio.
Los compuestos iónicos, a diferencia de los covalentes, suelen tener forma sólida. Además se caracterizan por su solubilidad en el agua y la alta capacidad de conducir electricidad. Igualmente, siempre se recalca que un enlace iónico no es siempre iónico, esto se debe a que generalmente siempre existen una compartición de electrones en alguna parte de un compuesto.
La finalidad del enlace químico es alcanzar un estado de equilibrio en la naturaleza. En general, los átomos de manera individual no son estableces, por eso se unen a otros para alcanzar la estabilidad. Hay, sin embargo, átomos que no necesitan unirse a otros para alcanzar el equilibrio, por ejemplo los gases nobles.
El enlace iónico y el covalente tienen diferentes propiedades
Una característica importante del enlace iónico es que el punto de ebullición es alto. En los covalentes, en cambio, la ebullición se produce a una temperatura menor.
El enlace covalente tiene, además, una forma clara y que se puede predecir. La fácil ruptura de este tipo de enlaces se debe a la unión entre los átomos en sus últimos niveles de energía, por lo cual es fácil separarlos y volverlos a su estado original. En general estos compuestos se encuentran en estado gaseoso y se caracterizan por tener polaridad.
